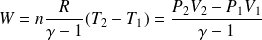Travail des forces de pression et transferts thermiques
Fondamental : Travail des forces de pression
Travail des forces de pression : échange d'énergie d'origine macroscopique, c'est-à-dire le travail des forces définies à notre échelle et qui s'exercent sur la surface délimitant le système.
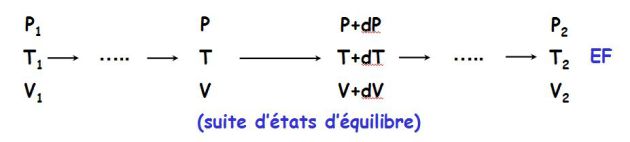
On considère un cylindre fermé par un piston mobile.
La force de pression extérieure s'écrit :
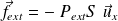
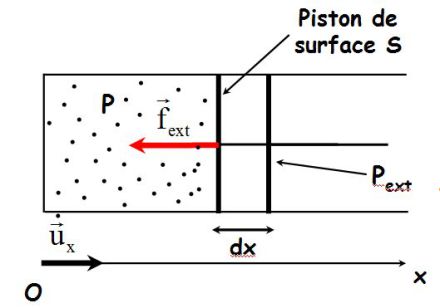
Lors d'un déplacement élémentaire du piston, son travail vaut :

Soit :
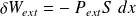
Or,
 (variation du volume du gaz, > 0 sur le dessin), ainsi :
(variation du volume du gaz, > 0 sur le dessin), ainsi :
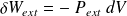
Ainsi :
Si
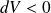 (le volume diminue) : le travail est positif (le gaz reçoit de l'énergie sous forme de travail).
(le volume diminue) : le travail est positif (le gaz reçoit de l'énergie sous forme de travail).Si
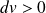 (le volume augmente) : le travail est négatif (le gaz se détend et fournit du travail à l'extérieur).
(le volume augmente) : le travail est négatif (le gaz se détend et fournit du travail à l'extérieur).
Ce résultat se généralise à un volume quelconque (gaz, liquide, solide).
Ainsi, le travail reçu de la part des forces de pressions extérieures par un système thermodynamique qui voit son volume varier de dV vaut :
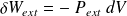
Méthode : Cas d'une transformation réversible, interprétation géométrique du travail
Lors d'une transformation réversible, la pression extérieure est constamment égale à la pression intérieure
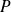 , c'est-à-dire celle du système.
, c'est-à-dire celle du système.
Par conséquent, le travail des forces de pression vaut :
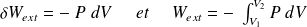
Remarque : si le volume reste constant, le travail des forces de pression est nul.
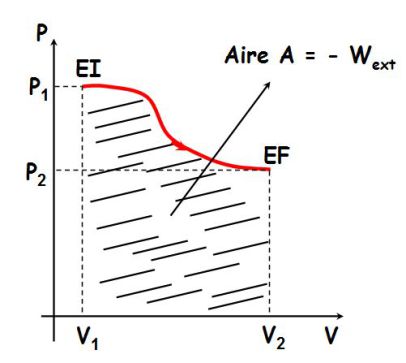
Interprétation géométrique du travail :
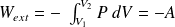
Ici,
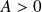 et
et
 :
:
le gaz reçoit un travail négatif (il fournit de l'énergie sous forme de travail à l'extérieur puisqu'il se détend).
Le plan (P,V) est appelé plan de Clapeyron (coordonnées de Clapeyron) ; attention, P est en ordonnée et V en abscisse !
Le travail dépend du chemin suivi pour aller d'un même état initial à un même état final, comme le montre la figure suivante :
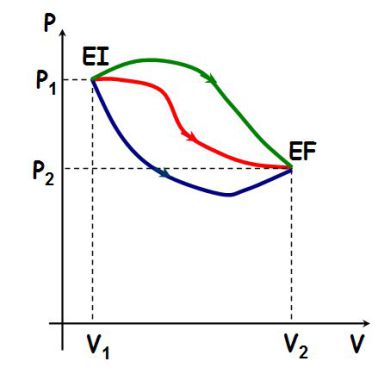
Les aires délimitées par chacune des trois courbes sont à chaque fois différentes : par conséquent, le travail reçu par un système dépend du chemin suivi et ne dépend pas uniquement de l'état initial et de l'état final.
Le travail n'est pas une fonction d'état.
Ne pas écrire :
 (mais
(mais
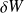 )
)
Ne pas écrire :
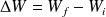 mais
mais
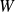 .
.
Cas d'un cycle réversible :
L'aire totale délimitée par le cycle donne l'opposé du travail total reçu par le système qui effectue le cycle.
Ici, W < 0 : le cycle est moteur.
Exemple : Quelques transformations particulières
Transformation à volume constant :
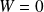
Transformation à pression extérieure constante
 :
: 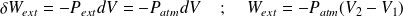
Transformation réversible isotherme d'un gaz parfait :
Parois diathermes (ou diathermanes) : parois qui laissent passer la chaleur (contrairement aux parois adiabatiques ou athermanes).
Thermostat (ou source de chaleur) : corps de très grande taille, dont la température reste constante (égale ici à T0) même lorsque le corps reçoit de la chaleur.
Ici, le gaz parfait subit une transformation réversible à température constante ; on parlera de transformation isotherme.
En utilisant l'équation d'état des gaz parfaits :

Et le travail total reçu par le gaz lors de la transformation est :
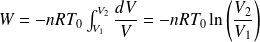
Sachant que (loi de Mariotte) :
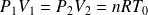
Il vient :

Et :
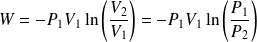
Fondamental : Transferts thermiques (quantités de chaleur)
Transfert thermique (« Chaleur ») : échange d'énergie au niveau microscopique (exemple : récipient rigide contenant un gaz et placé sur une plaque chauffante).
On note Q le transfert thermique reçu par un système (grandeur algébrique, > ou < 0).
Q s'exprime en Joule (J) dans le SI.
Historiquement, on utilise la calorie : 1 cal = 4,18 J :
« La calorie est la quantité de chaleur nécessaire pour augmenter la température d'un gramme d'eau de 1°C (de 1 K) à pression constante de 1 bar et à partir de 14,5°C. »
Quelques ordres de grandeurs :
On chauffe 1 kg d'eau de 20°C à 100°C sous 1 bar :
Q = 80 kcal = 334,4 kJ
On transforme 1 kg d'eau liquide en vapeur à 100°C sous 1 bar :
Q = 2 255 kJ
(Q est ici appelée chaleur latente de vaporisation de l'eau).
Exemple : Transformation adiabatique
Lors d'une transformation adiabatique, le système ne reçoit pas de transfert thermique (Q = 0).
Le 1er principe donne alors :

Pour un gaz parfait monoatomique, par exemple :

Par conséquent, si W > 0 (compression de l'air dans une pompe à vélo), alors
 : le gaz s'échauffe alors qu'il n'a pas reçu de chaleur !
: le gaz s'échauffe alors qu'il n'a pas reçu de chaleur !
Il est ainsi important de ne pas nécessairement associer quantité de chaleur et modification de température !
Exemple : Transformation à pression extérieure constante
On définit la fonction d'état enthalpie :
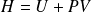
Le transfert thermique est alors donné par :

Exemple : Transformation adiabatique réversible d'un GP, loi de Laplace
Hypothèse : pas de transfert de chaleur et réversibilité de la transformation.
Les lois de Laplace sont vérifiées :
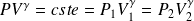
Ou, ce qui est équivalent :

Remarquer que le travail reçu par le gaz lors de la transformation est directement donné par :
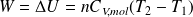
Soit :