Les premier et second principes de la thermodynamique
Fondamental : Définition de l'énergie interne
On considère un système thermodynamique (S) au repos dans le référentiel (R) du laboratoire (gaz dans un récipient, un solide, ...).
L'énergie interne désigne l'énergie mécanique de ce système, évaluée dans (R) :

Somme des énergies cinétiques microscopiques des constituants du système et de l'énergie potentielle d'interaction mutuelle entre les constituants.
L'énergie interne est une fonction d'état du système : elle est définie à l'état d'équilibre du système thermodynamique.
C'est une fonction des variables d'état du système.
Si le système est en mouvement dans (R), son énergie mécanique Em sera alors, en prenant en compte l'énergie cinétique macroscopique et l'énergie potentielle macroscopique de pesanteur :
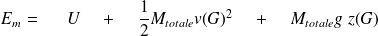
Fondamental : Énoncé du premier principe
On considère un système thermodynamique (S) fermé et immobile dans le référentiel du laboratoire (R).
Ce système subit une transformation durant laquelle son énergie interne varie de :


Cette variation est due à deux contributions :
Aux travaux W des forces (de pression, par exemple) qui s'exercent sur le système (S).
Aux transferts thermiques (quantités de chaleur) Q reçus par le système (S).
Le premier principe de la thermodynamique est un principe de conservation de l'énergie :
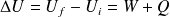
Pour une transformation élémentaire (réversible ou quasi statique) :
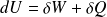
Si le système (S) est animé d'un mouvement d'ensemble par rapport au référentiel (R) du laboratoire :

Fondamental : Transformations particulières
Transformation purement thermique (W = 0) :

Transformation adiabatique (Q = 0) :

Transformation cyclique (suite de transformations durant lesquelles le système revient à son état initial) :
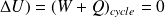
Fondamental : Énoncé du second principe de la thermodynamique
Une vidéo amusante : "L'entropie vue par les Shadoks"
L'entropie est une fonction d'état, additive et extensive.
Expression élémentaire du 2nd principe :
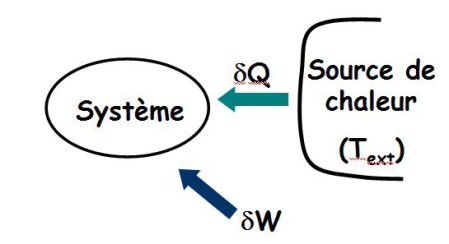
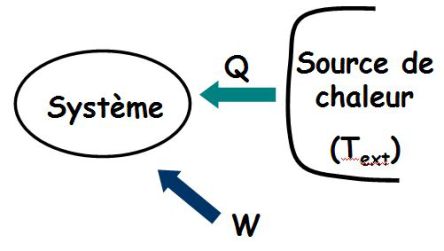
Le système reçoit travail et chaleur.
Sa variation d'entropie dS vérifie :
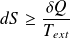
Ce que l'on écrit sous la forme :

Avec :
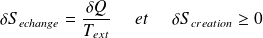
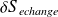 : l'entropie d'échange dépend des échanges de chaleur avec l'extérieur ; son signe est quelconque.
: l'entropie d'échange dépend des échanges de chaleur avec l'extérieur ; son signe est quelconque.
 : l'entropie de création (positive ou nulle, uniquement dans le cas d'une transformation réversible) est liée aux transformations internes au système et caractérise le degré d'irréversibilité de la transformation (hétérogénéité de températures, de concentrations, déséquilibre de pression, ...).
: l'entropie de création (positive ou nulle, uniquement dans le cas d'une transformation réversible) est liée aux transformations internes au système et caractérise le degré d'irréversibilité de la transformation (hétérogénéité de températures, de concentrations, déséquilibre de pression, ...).
Expression du 2nd principe pour une transformation finie :
Le système reçoit travail et chaleur.
Sa variation d'entropie
 vérifie :
vérifie :
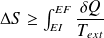
Ce que l'on écrit sous la forme :

Avec :
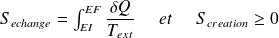
Méthode : En pratique, comment réaliser un bilan entropique ?
Calcul de
 :
: Se calcule en imaginant une transformation réversible amenant du même EI au même EF ou directement si l'on connaît la fonction entropie (GP, par exemple).
Calcul de
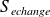 :
: 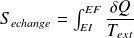
se calcule sur le chemin réellement suivi.
Calcul de
 :
: se calcule ensuite avec :
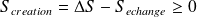
Si la transformation est réversible :
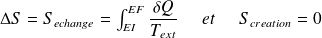
Exemple : Un exemple de bilan entropique
On place un métal chaud à la température T1 (masse m,capacité calorifique massique cm) dans l'eau d'une piscine à la température T0 < T1.
Faire un bilan entropique.
On calcule la variation d’entropie de l'eau (phase incompressible) :

L'entropie d'échange se calcule sur le chemin réellement suivi :
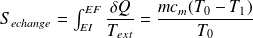
On en déduit l'entropie de création :

Soit encore :

Fondamental : Entropie d'un gaz parfait
En variables
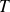 et
et
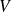 :
: 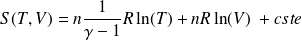
En variables
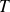 et
et
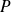 :
: 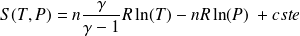
Avec
 .
.
Complément : Interprétation statistique de l'entropie
L'entropie du bureau d'un étudiant se rapproche-t-elle plutôt de celle du bureau de gauche ou de celle du bureau de droite ?
Si on appelle
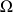 le nombre d'états microscopiques accessibles par le système macroscopique, alors l'entropie peut s'écrire sous la forme :
le nombre d'états microscopiques accessibles par le système macroscopique, alors l'entropie peut s'écrire sous la forme :
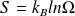
où
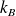 est la constante de Boltzmann.
est la constante de Boltzmann.
Finalement, un système sera d'autant plus désordonné que son entropie sera grande.
En particulier, lors d'un changement d'état liquide - gaz par exemple, l'entropie du corps va augmenter puisque l'état gazeux est moins ordonné que l'état liquide.


