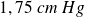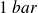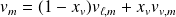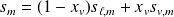Changements d'états des corps purs
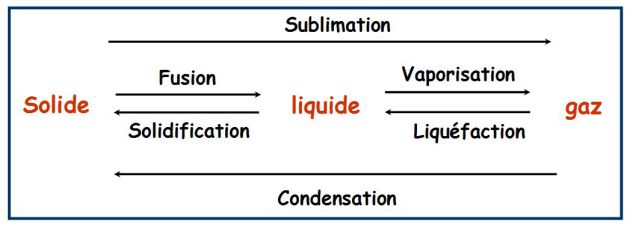
Définition : Un peu de vocabulaire
Fondamental : Conditions d'équilibre
On symbolise l'équilibre entre deux phases par :
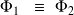
C'est un équilibre réversible, qui s'effectue à P et T constantes.
Par exemple, pour l'eau, la température de fusion est de 0°C et celle de vaporisation de 100°C, pour une pression de 1 bar.
Au sommet du Mont-Blanc, la pression devient de l'ordre de 0,50 bar. La température de fusion ne varie pas et la température de vaporisation devient 85°C.
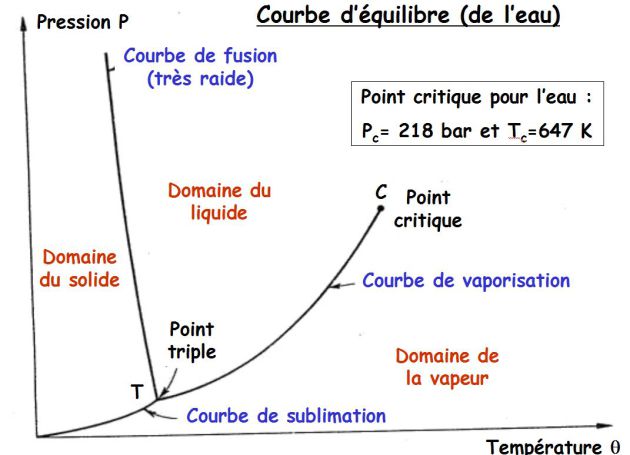
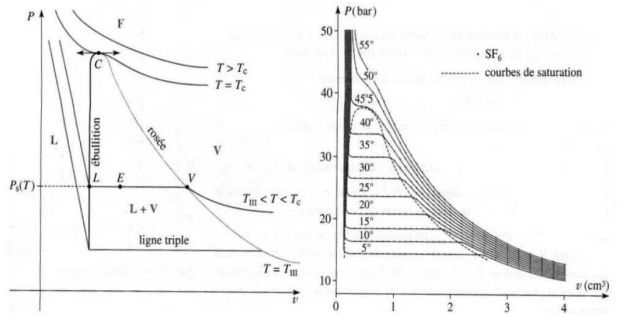
La courbe d'équilibre indique les températures et les pressions pour lesquelles les changements d'états se produisent.
La courbe précédente donne la courbe d'équilibre de l'eau (courbe de fusion de pente négative).
Pour tous les autres corps, la courbe de fusion a une pente positive.
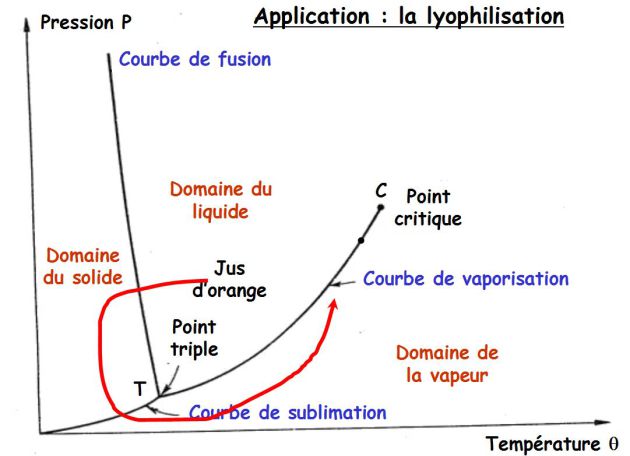
La figure suivante explique le principe de la lyophilisation du jus d'orange.
Le jus d'orange liquide est refroidi à pression constante et devient solide.
On diminue ensuite la pression à température constante afin de le sublimer.
Fondamental : Enthalpie de changements d'états
On considère le changement de phase réversible, qui s'effectue à P et T déterminées (avec P = P(T), donnée par la courbe d'équilibre) :
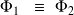
On appelle enthalpie massique de changement d'états la quantité :

A pression constante (c'est le cas ici),
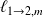 s'interprète comme étant la chaleur nécessaire à fournir lors du changement d'états :
s'interprète comme étant la chaleur nécessaire à fournir lors du changement d'états :
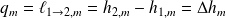
Exemples :

Remarques :

Si m désigne la masse initiale de la phase (1), alors :
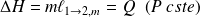
Méthode : Variations des fonctions d'états
On considère l'équilibre :
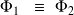
Alors :
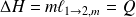
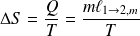

Fondamental : Étude de l'équilibre liquide - vapeur
Pression de vapeur saturante :
Si on introduit un liquide pur dans un récipient vide et fermé (en quantité suffisante), ce liquide se vaporise partiellement.
Cette vaporisation s'arrête lorsque la pression au dessus du liquide (pression de la phase gazeuse) atteint une certaine valeur, appelée « pression de vapeur saturante », donnée par la courbe de vaporisation.
Cette pression Ps(T) ne dépend que de la température.
Exemple (pour l'eau) :
|
|
| 10°C |
| 20°C |
| 50°C |
| 100°C |
Évaporation et Ébullition :
Évaporation : si le récipient précédent est ouvert, la pression de vapeur saturante ne peut être atteinte (quelle que soit la quantité de liquide) : tout le liquide s'évapore.
Ébullition : un liquide se met à bouillir lorsque la pression de vapeur saturante à la température T considérée est égale à la pression P que supporte le liquide.
La pression de vapeur est suffisante pour que des bulles de vapeur se forment au sein même du liquide.
Pour l'eau :
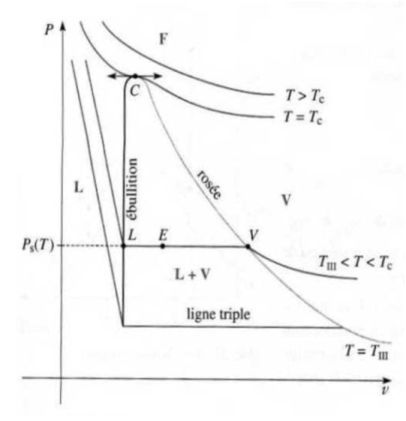
Courbe de saturation, isothermes d'Andrews :
On effectue des compressions isothermes de vapeur sèche contenue dans un cylindre fermé par un piston.
On construit ainsi la courbe de saturation (dans le plan de Clapeyron (
 )).
)).
On trace un réseau d'isothermes d'Andrews, constitué de courbes donnant, pour une température donnée, l'évolution de la pression du gaz enfermé dans le cylindre en fonction du volume qu'il occupe.
La courbe de saturation et l'isotherme critique délimitent, dans le diagramme de Clapeyron, quatre zones différentes : l'état liquide, l'état gaz, l'état diphasé liquide-gaz et un état fluide où l'on ne peut plus affirmer que le fluide est sous l'état liquide ou gazeux.
Définition : Fonctions d'états du système diphasé
On note
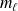 et
et
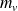 les masses de liquide et de vapeur sur le palier de changement d'état (système diphasé).
les masses de liquide et de vapeur sur le palier de changement d'état (système diphasé).
Soit
 la masse totale du système diphasé :
la masse totale du système diphasé :

sont respectivement les titres massiques en liquide et en vapeur du système diphasé.
On a évidemment :
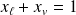
Théorème » des moments :
Soient
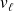 et
et
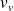 les volumes massiques du liquide et de la vapeur et
les volumes massiques du liquide et de la vapeur et
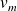 le volume massique total occupé par le système diphasé :
le volume massique total occupé par le système diphasé :
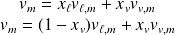
On en déduit :
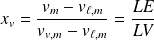
Fonctions d'états du système diphasé :
Avec des notations évidentes :
Pour un système de masse m :

Quelques relations entre ces grandeurs :

Et :
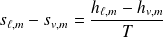
Complément : Implosion d'une canette de Coca
Complément :
Fabriquer un nuage dans une bouteille